(톱스타뉴스 박동현 기자)
뉴시스 제공
국산 코로나19 진단키트가 전 세계 110여개국에 5646만명을 검사할 수 있는 분량을 수출했다.
식품의약품안전처는 22일 “포스트 코로나 시대에도 K-방역의 명성을 확고히 하겠다”고 밝혔다.
식약처에 따르면, 지난 20일 기준 73개 코로나19 진단키트가 수출용 허가를 받아 미국, 이탈리아, 브라질, 사우디아라비아, 이집트, 인도네시아 등 110여개국에 수출되고 있다.
이 중 유전자 증폭 등 분자진단 방식이 50개, 특정 항체를 검출하는 등 면역진단 방식이 23개다.
전 세계 5646만명이 코로나19 진단검사를 받을 수 있는 물량이 해외로 수출됐다.
특히 7개 제품은 미국 FDA의 긴급사용승인을 받아 해외 진출이 더욱 확대될 전망이다. 오상헬스케어, 씨젠, SD바이오센서, 시선바이오머티리얼스, 랩지노믹스, 진매트릭스, 바이오코아 등이다.
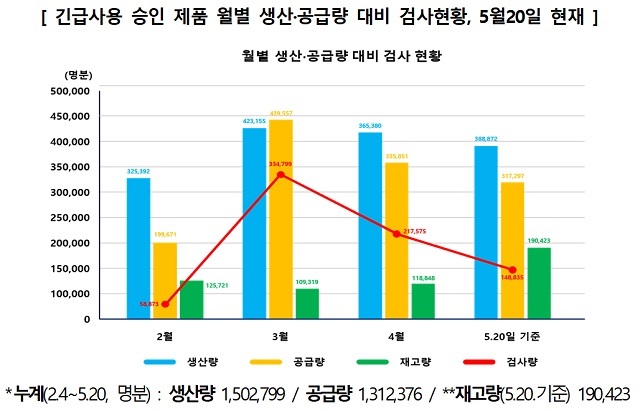
국내에선 6개 제품이 긴급사용승인을 받아 그동안(5월20일 기준) 총 150만명분이 생산됐다. 1일 최대 생산량은 약 15만명분이다. 코젠바이오텍, 씨젠, 솔젠트, SD바이오센서, 바이오세움, 바이오코아 등의 제품이다.
식약처는 “이 중 131만명분이 공급됐고 지금까지 총 76만건의 검사를 진행했으며, 현재 약 19만명분을 재고로 확보해 안정적인 수급을 이어가고 있다”고 설명했다.
식약처는 진단에 6시간 걸리는 기존 긴급사용승인 제품과는 별개로 결과가 1시간 이내에 나오는 응급용 코로나 진단키트를 승인하기 위한 절차도 마련됐다. 응급수술 등 시급한 환자에 사용할 예정이다.
또 코로나19 진단키트의 긴급사용승인 및 수출용 허가를 정식 허가로 전환하고, 개발 및 허가 기간을 최대 150일 단축한다.
신청 준비단계에서 맞춤형 컨설팅을 지원해 허가 신청서류 준비기간을 단축(30일→7일)한다. 임상 시험단계에선 가이드 제공과 시험계획서 신속 승인으로 단축(90→22일)되고, 심사·허가단계에선 최대 50일 단축(80→30일 이내)될 예정이다.
K-방역모델 국제표준화도 추진한다. 관련 부처 및 민간전문가와 협력해 ‘감염병 진단기법’ 관련 표준 2종 및 ‘진단키트 긴급사용승인 절차’ 관련 표준 1종 등 K-방역모델의 국제표준 제정 작업을 추진 중이다.
진단시약 전주기 안전관리 정책도 수립할 계획이다. 체외진단의료기기의 개발, 임상성능평가, 품질관리체계, 허가 및 제품화까지 전주기 안전관리 전담 조직을 신설할 방침이다.
장기적으론 포스트 코로나 시대에 대비해 국내 진단시약의 품질향상과 임상평가 전문성을 제고할 예정이다. 품질관리에 필요한 표준품 제조·관리·분양, 국내외 기술정보, 최신 임상정보 등을 적기에 제공해 업계의 자체 품질 향상을 도모한다.

식품의약품안전처는 22일 “포스트 코로나 시대에도 K-방역의 명성을 확고히 하겠다”고 밝혔다.
식약처에 따르면, 지난 20일 기준 73개 코로나19 진단키트가 수출용 허가를 받아 미국, 이탈리아, 브라질, 사우디아라비아, 이집트, 인도네시아 등 110여개국에 수출되고 있다.
이 중 유전자 증폭 등 분자진단 방식이 50개, 특정 항체를 검출하는 등 면역진단 방식이 23개다.
전 세계 5646만명이 코로나19 진단검사를 받을 수 있는 물량이 해외로 수출됐다.
특히 7개 제품은 미국 FDA의 긴급사용승인을 받아 해외 진출이 더욱 확대될 전망이다. 오상헬스케어, 씨젠, SD바이오센서, 시선바이오머티리얼스, 랩지노믹스, 진매트릭스, 바이오코아 등이다.
국내에선 6개 제품이 긴급사용승인을 받아 그동안(5월20일 기준) 총 150만명분이 생산됐다. 1일 최대 생산량은 약 15만명분이다. 코젠바이오텍, 씨젠, 솔젠트, SD바이오센서, 바이오세움, 바이오코아 등의 제품이다.
식약처는 “이 중 131만명분이 공급됐고 지금까지 총 76만건의 검사를 진행했으며, 현재 약 19만명분을 재고로 확보해 안정적인 수급을 이어가고 있다”고 설명했다.
식약처는 진단에 6시간 걸리는 기존 긴급사용승인 제품과는 별개로 결과가 1시간 이내에 나오는 응급용 코로나 진단키트를 승인하기 위한 절차도 마련됐다. 응급수술 등 시급한 환자에 사용할 예정이다.
또 코로나19 진단키트의 긴급사용승인 및 수출용 허가를 정식 허가로 전환하고, 개발 및 허가 기간을 최대 150일 단축한다.
신청 준비단계에서 맞춤형 컨설팅을 지원해 허가 신청서류 준비기간을 단축(30일→7일)한다. 임상 시험단계에선 가이드 제공과 시험계획서 신속 승인으로 단축(90→22일)되고, 심사·허가단계에선 최대 50일 단축(80→30일 이내)될 예정이다.
K-방역모델 국제표준화도 추진한다. 관련 부처 및 민간전문가와 협력해 ‘감염병 진단기법’ 관련 표준 2종 및 ‘진단키트 긴급사용승인 절차’ 관련 표준 1종 등 K-방역모델의 국제표준 제정 작업을 추진 중이다.
진단시약 전주기 안전관리 정책도 수립할 계획이다. 체외진단의료기기의 개발, 임상성능평가, 품질관리체계, 허가 및 제품화까지 전주기 안전관리 전담 조직을 신설할 방침이다.
장기적으론 포스트 코로나 시대에 대비해 국내 진단시약의 품질향상과 임상평가 전문성을 제고할 예정이다. 품질관리에 필요한 표준품 제조·관리·분양, 국내외 기술정보, 최신 임상정보 등을 적기에 제공해 업계의 자체 품질 향상을 도모한다.
<저작권자 © 톱스타뉴스 무단전재 및 재배포 금지> 2020/05/22 14:59 송고 | reporter@topstarnews.co.kr
기자의 보도 내용에 비판은 수용하며, 반론권을 보장합니다. 그러나 폭력적인 욕설이나 협박에 대해서는 합의 없는 형사 처벌을 추진하므로 유의하시기 바랍니다. 또한 톱스타뉴스의 모든 콘텐츠(영상, 기사, 사진)는 저작권법의 보호를 받습니다. 무단 전재, 복사, 배포, 유튜브 영상 제작을 금합니다. 발견 즉시 민형사상 제소합니다.
Tag
#newsis



 기사를 추천하면 투표권을 받을 수 있습니다.
기사를 추천하면 투표권을 받을 수 있습니다.  모바일 모드로 보기 Go to the Mobile page.
모바일 모드로 보기 Go to the Mobile page.



 1일 투표권 3개 받기
1일 투표권 3개 받기