(톱스타뉴스 윤우진 기자)
뉴시스 제공
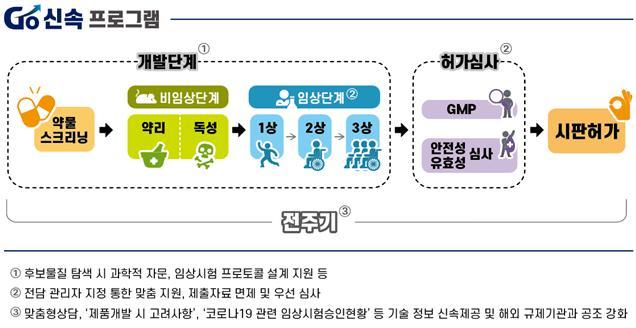
식품의약품안전처는 신속한 코로나19 치료제·백신 개발을 위해 ‘고강도 신속 제품화 촉진 프로그램’(고(GO)·신속 프로그램)을 가동한다고 13일 밝혔다.
고(Go)·신속프로그램은 제품의 효과․안전성은 확보하면서 각 단계별 시행착오를 최소화해 개발기간을 단축하는 것을 주요 내용으로 한다. 연구개발·임상승인·허가심사·정보공유·국제공조에 대한 정부의 차별화된 지원전략이다.
◇연구지원
정부·출연연구소가 진행하는 후보물질 탐색 시 제품화 가능성 있는 물질을 결정하기 위한 과학적 자문을 제공할 예정이다. 개발자들이 제품 효능평가에서 활용할 수 있도록 코로나 19 바이러스 감염 동물모델을 개발·공유하고 치료제·백신 임상프로토콜 개발 등을 지원한다.
◇허가심사 지원
연구 개발부터 허가심사 전 단계에 걸친 ‘코로나 19 전담 상담창구’를 개설한다. 치료효과를 기대할 수 있는 품목에 대해 전담관리자(Project Manager)를 지정, 개발단계별로 맞춤 지원하기로 했다.
안전성이 입증된 플랫폼을 사용해 개발한 백신은 독성시험을 면제하는 등 코로나19 예방 또는 치료효과를 기대할 수 있는 의약품에 대해 개발단계에 맞는 최소한의 자료 제출로 임상시험에 진입할 수 있도록 도울 계획이다.
또 경험 있는 심사자로 구성된 심사팀을 운영해 사용 경험이 있는 물질의 경우 7일 이내, 신물질의 경우 15일 이내로 임상시험 심사기간을 획기적으로 단축할 예정이다. 허가를 할 때에도 우선적으로 신속하게 처리할 예정이다.
◇기술정보 지원
임상시험 설계 방법 등의 내용을 담은 ‘코로나19 치료제 개발 시 고려사항’ 및 임상시험 중 자주 묻는 질의·응답 등의 정보를 제공하고 치료제와 백신 임상시험 승인현황을 신속히 공개할 계획이다.
◇국내·외 협력지원
의약품 규제기관 국제 연합(ICMRA) 등 국제적 공조를 통해 각국에서 진행되는 임상시험 및 심사정보를 공유할 계획이다. 개발자들이 제품 개발과정 중 발생하는 애로사항이나 질의사항을 즉각적으로 해소할 수 있도록 ‘제품화지원팀장’과 핫라인을 설치·운영한다.
식약처는 “정부 관계 기관을 비롯해 산업계, 학계, 연구소, 병원 등과 협력해 안전하고 효과 있는 치료제와 백신을 신속히 개발할 수 있도록 모든 역량을 모으겠다”고 강조했다.

고(Go)·신속프로그램은 제품의 효과․안전성은 확보하면서 각 단계별 시행착오를 최소화해 개발기간을 단축하는 것을 주요 내용으로 한다. 연구개발·임상승인·허가심사·정보공유·국제공조에 대한 정부의 차별화된 지원전략이다.
◇연구지원
정부·출연연구소가 진행하는 후보물질 탐색 시 제품화 가능성 있는 물질을 결정하기 위한 과학적 자문을 제공할 예정이다. 개발자들이 제품 효능평가에서 활용할 수 있도록 코로나 19 바이러스 감염 동물모델을 개발·공유하고 치료제·백신 임상프로토콜 개발 등을 지원한다.
◇허가심사 지원
연구 개발부터 허가심사 전 단계에 걸친 ‘코로나 19 전담 상담창구’를 개설한다. 치료효과를 기대할 수 있는 품목에 대해 전담관리자(Project Manager)를 지정, 개발단계별로 맞춤 지원하기로 했다.
안전성이 입증된 플랫폼을 사용해 개발한 백신은 독성시험을 면제하는 등 코로나19 예방 또는 치료효과를 기대할 수 있는 의약품에 대해 개발단계에 맞는 최소한의 자료 제출로 임상시험에 진입할 수 있도록 도울 계획이다.
또 경험 있는 심사자로 구성된 심사팀을 운영해 사용 경험이 있는 물질의 경우 7일 이내, 신물질의 경우 15일 이내로 임상시험 심사기간을 획기적으로 단축할 예정이다. 허가를 할 때에도 우선적으로 신속하게 처리할 예정이다.
◇기술정보 지원
임상시험 설계 방법 등의 내용을 담은 ‘코로나19 치료제 개발 시 고려사항’ 및 임상시험 중 자주 묻는 질의·응답 등의 정보를 제공하고 치료제와 백신 임상시험 승인현황을 신속히 공개할 계획이다.
◇국내·외 협력지원
의약품 규제기관 국제 연합(ICMRA) 등 국제적 공조를 통해 각국에서 진행되는 임상시험 및 심사정보를 공유할 계획이다. 개발자들이 제품 개발과정 중 발생하는 애로사항이나 질의사항을 즉각적으로 해소할 수 있도록 ‘제품화지원팀장’과 핫라인을 설치·운영한다.
식약처는 “정부 관계 기관을 비롯해 산업계, 학계, 연구소, 병원 등과 협력해 안전하고 효과 있는 치료제와 백신을 신속히 개발할 수 있도록 모든 역량을 모으겠다”고 강조했다.
<저작권자 © 톱스타뉴스 무단전재 및 재배포 금지> 2020/04/13 10:57 송고 | reporter@topstarnews.co.kr
기자의 보도 내용에 비판은 수용하며, 반론권을 보장합니다. 그러나 폭력적인 욕설이나 협박에 대해서는 합의 없는 형사 처벌을 추진하므로 유의하시기 바랍니다. 또한 톱스타뉴스의 모든 콘텐츠(영상, 기사, 사진)는 저작권법의 보호를 받습니다. 무단 전재, 복사, 배포, 유튜브 영상 제작을 금합니다. 발견 즉시 민형사상 제소합니다.
Tag
#newsis



 기사를 추천하면 투표권을 받을 수 있습니다.
기사를 추천하면 투표권을 받을 수 있습니다.  모바일 모드로 보기 Go to the Mobile page.
모바일 모드로 보기 Go to the Mobile page.



 1일 투표권 3개 받기
1일 투표권 3개 받기