(톱스타뉴스 박수철 기자)
뉴시스 제공
[박수철 기자] 뉴시스에 따르면 식품의약품안전처는 27일 코로나19 치료제·백신의 신속한 개발을 위해 해당 임상시험에 대해 우선·신속 심사하고 있다고 27일 밝혔다.
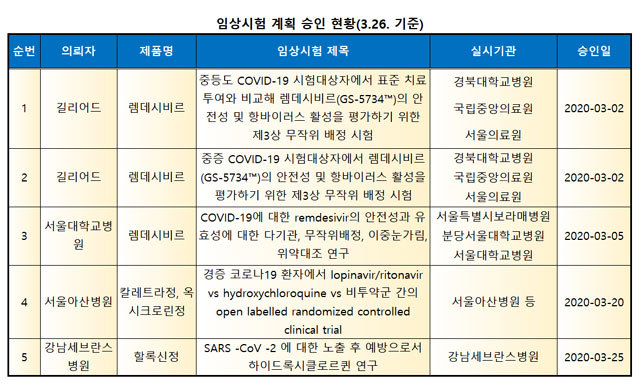
식약처에 따르면 코로나19 관련 임상시험은 현재 11건이 신청됐다. 이 중 대한감염학회·대한항균요법학회 등 전문가 자문을 거쳐 5건을 승인했다.
이는 ▲렘데시비르(에볼라 치료제) 관련 임상 3건 ▲칼레트라(인체 면역결핍 바이러스 감염 치료제)와 히드록시클로로퀸(말라리아 치료제) 관련 임상 1건 ▲히드록시클로로퀸정 임상 1건 등이다.
또 인플루엔자 치료제로 임상시험 중인 의약품을 코로나19 치료 목적으로 사용할 수 있도록 6건을 승인했다. 모두 이뮨메드의 ‘HzVSF v13’이다. 10건은 검토 중이다.
‘치료 목적 사용 승인’이란 생명이 위급하거나 대체 치료 수단이 없는 응급환자의 치료를 위해 시판허가 전인 임상시험용 의약품을 사용할 수 있도록 승인하는 제도다.
이들 승인은 모두 치료제 개발에 국한됐다. 아직 코로나19를 예방할 백신 임상시험은 승인되지 않은 것으로 확인됐다.
현재 백신 개발 계획을 발표한 국내 제약바이오 기업은 SK바이오사이언스, GC녹십자, 신라젠 등이다.

식약처에 따르면 코로나19 관련 임상시험은 현재 11건이 신청됐다. 이 중 대한감염학회·대한항균요법학회 등 전문가 자문을 거쳐 5건을 승인했다.
이는 ▲렘데시비르(에볼라 치료제) 관련 임상 3건 ▲칼레트라(인체 면역결핍 바이러스 감염 치료제)와 히드록시클로로퀸(말라리아 치료제) 관련 임상 1건 ▲히드록시클로로퀸정 임상 1건 등이다.
또 인플루엔자 치료제로 임상시험 중인 의약품을 코로나19 치료 목적으로 사용할 수 있도록 6건을 승인했다. 모두 이뮨메드의 ‘HzVSF v13’이다. 10건은 검토 중이다.
‘치료 목적 사용 승인’이란 생명이 위급하거나 대체 치료 수단이 없는 응급환자의 치료를 위해 시판허가 전인 임상시험용 의약품을 사용할 수 있도록 승인하는 제도다.
이들 승인은 모두 치료제 개발에 국한됐다. 아직 코로나19를 예방할 백신 임상시험은 승인되지 않은 것으로 확인됐다.
현재 백신 개발 계획을 발표한 국내 제약바이오 기업은 SK바이오사이언스, GC녹십자, 신라젠 등이다.
<저작권자 © 톱스타뉴스 무단전재 및 재배포 금지> 2020/03/27 14:39 송고 | reporter@topstarnews.co.kr
기자의 보도 내용에 비판은 수용하며, 반론권을 보장합니다. 그러나 폭력적인 욕설이나 협박에 대해서는 합의 없는 형사 처벌을 추진하므로 유의하시기 바랍니다. 또한 톱스타뉴스의 모든 콘텐츠(영상, 기사, 사진)는 저작권법의 보호를 받습니다. 무단 전재, 복사, 배포, 유튜브 영상 제작을 금합니다. 발견 즉시 민형사상 제소합니다.
Tag
#newsis


 기사를 추천하면 투표권을 받을 수 있습니다.
기사를 추천하면 투표권을 받을 수 있습니다.  모바일 모드로 보기 Go to the Mobile page.
모바일 모드로 보기 Go to the Mobile page.



 1일 투표권 3개 받기
1일 투표권 3개 받기